空气密度与温度的关系
空气密度与温度的关系为:等质量的气体,在压强不变的情况下,温度与密度呈反比。具体解释如下:等质量等压强下的关系:根据标准气体方程PV=nRT,在压强P和物质的量n不变的情况下,温度T与体积V成正比,即V/T=常量。
空气密度与温度的关系为:等质量的气体,在压强不变的情况下,温度与密度呈反比。具体解释如下:标准气体方程的理解:根据标准气体方程PV=nRT,在压强P和物质的量n不变的情况下,温度和体积V呈正比,即V/T=常量。
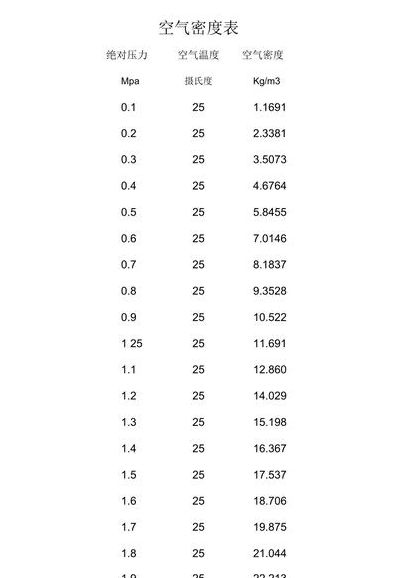
空气密度与温度的关系是紧密相连。空气密度是指在一定的温度和压力下,单位体积空气所具有的质量就是空气密度。在标准条件下(0℃,1个标准大气压(1atm)),空气密度约为29Kg/m3。空气密度=293x(实际压力/标准物理大气压)x(2715/实际绝对温度),绝对温度=摄氏温度+2715。
空气密度与温度之间存在着密切的关系。空气密度是指单位体积内空气质量的大小,通常用千克每立方米(kg/m)表示。而温度则是衡量空气分子热运动剧烈程度的物理量,常用摄氏度(℃)或开尔文(K)表示。下面我们来探讨一下空气密度与温度之间的关系。首先,我们需要了解空气的组成。
常见气体密度与空气的比较
1、空气的相对分子质量约为29。对于相对分子质量小于29的气体,其密度小于空气;相对分子质量大于29的气体,其密度大于空气。 密度小于空气的气体包括:氢气、乙烯、乙炔、一氧化碳,以及氮气(稍小于空气密度)。 密度大于空气的气体包括:氧气、二氧化碳、一氧化氮、二氧化氮、三氧化硫,以及二氧化硫。
2、氧气是一种无色无味的气体,其熔点为-218℃,沸点为-181℃。在标准条件下,氧气的相对密度为14,相对于水的密度为1。其相对蒸气密度为43,相对于空气的密度为1。在-164℃时,氧气的饱和蒸气压达到5062kPa,而其临界温度为-1195℃,临界压力为08MPa。
3、氧气的密度 无色无味气体 熔点-218℃ 沸点-181℃ 相对密度14(-183℃,水=1)相对蒸气密度43(空气=1)饱和蒸气压5062kPa(-164℃)临界温度-1195℃ 临界压力08MPa 空气的密度 空气的密度约为29Kg/立方米。
空气温度,密度,压强,体积如何变化?
1、其方程为pV = nRT。这个方程有4个变量:p是指理想气体的压强,V为理想气体的体积,n表示气体物质的量,而T则表示理想气体的热力学温度;还有一个常量:R为理想气体常数。可以看出,此方程的变量很多。因此此方程以其变量多、适用范围广而著称,对常温常压下的空气也近似地适用。
2、最后,当温度保持恒定时,压强与体积之间也存在反比关系。即,当气体体积增大时,压强会减小;反之,当体积减小时,压强会增大。这是因为温度不变意味着分子的平均动能保持不变,因此在体积增大的情况下,气体分子在单位体积内的密度会减小,碰撞频率降低,从而导致压强下降。
3、根据克拉伯龙方程 PV=nRT P=nRT/V 大气压强与气体质量,温度温度成正比关系,和体积成反比关系。气体质量越大、温度越高、体积越小,压强越高;气体质量越小、温度越低、体积越大,压强越低。
4、当温度升高时,分子热运动加剧,分子间的平均距离增大,导致单位体积内的分子数减少,即密度降低。反之,当温度降低时,分子热运动减缓,分子间的平均距离减小,单位体积内的分子数增加,密度增大。
5、一定质量的气体,在压强不变的情况下,温度升高,体积会显著增大,密度大幅减小;温度降低,体积缩小,密度增大。比如热气球,就是利用加热空气,使空气温度升高,密度变小,从而产生浮力实现升空。不过也有特殊情况,有些物质在特定温度区间内,温度变化对其密度影响极小,可近似认为密度不变 。
求气压和密度的关系!~~~(高分!~)
1、在温度一定的情况下,气压和密度成正比关系。解:对于气体由理想气体状态方程PV=nRT,其中P为气体的气压,V为气体的体积,n为气体的物质的量,R为比例常数,T为温度。又因为n=m/M=ρ*V/M,其中M为气体的摩尔质量,ρ为气体密度。
2、有关系。其他物理指标相同时,气体密度越大,压强越大。被密封在某种容器中的气体,其压强是大量的做无规则运动的气体分子对容器壁不断碰撞而产生的.它的大小不是由被封闭气体的重力所决定。同温度条件下,同体积的密闭容器中,气体密度越大,气压越大。
3、大气压越高,物体密度越大;大气压越低,物体密度越小。
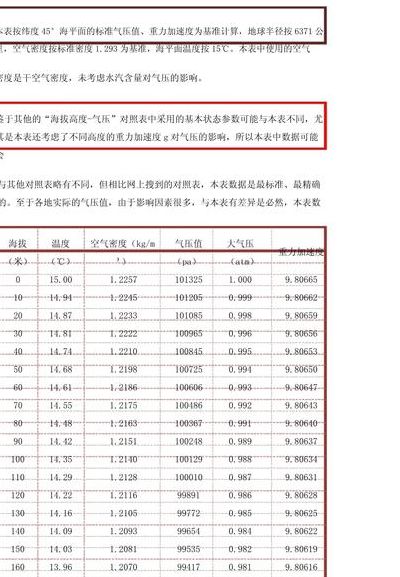
4、大气压随着高度的升高而降低,而空气密度则随着高度的升高而降低,所以大气压高则空气密度大。空气密度与气压的关系p=ρRT/M。其中M为气体的摩尔质量,ρ为气体密度,R为比例常数,对任意理想气体而言,R是一定的。其方程为pV=nRT。