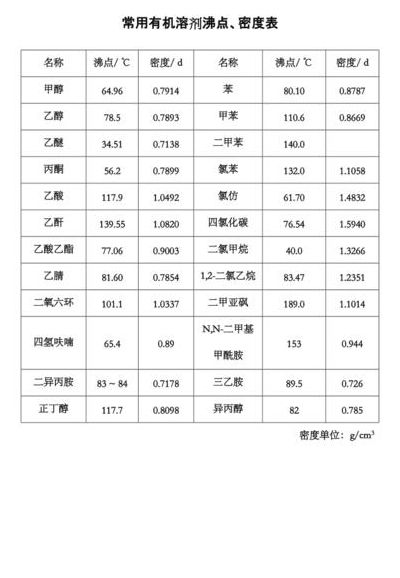
硫酸的沸点为多少?
1、硫酸 (H2SO4 ) 一般特点:沸点随浓度升高而升高。如:浓度 5% ,其沸点为 101 ℃;浓度 50% ,其沸点为124℃;浓度 98% ,其沸点为 332℃。
2、硫酸(h2so4 ) 一般特点:沸点随浓度升高而升高.如:浓度 5% ,其沸点为 101 ℃;浓度 50% ,其沸点为124℃;浓度 98% ,其沸点为 332℃.,挥发性最强肯定在沸腾时。
3、硫酸的沸点为338°C,远高于水的沸点,因此常在化学实验和工业生产中使用。高温下,硫酸会产生有毒的蒸汽,这些蒸汽不仅会刺激眼睛、鼻子和喉咙,还会导致皮肤接触部位灼伤。如果长时间暴露在这种蒸汽中,还可能导致肺部感染和严重的呼吸道疾病。
4、硫酸是一种常见的化学物质,其纯度为100%时,沸点约为340℃。这一特性使得硫酸在化学工业中扮演着重要角色。在实验室和工业生产中,这种高沸点的特性可以用于硫酸的精炼和纯化过程,确保其在高温下仍能保持稳定。
5、硫酸(H2SO4)的沸点随浓度的增加而上升。例如,5%浓度的硫酸沸点为101℃,而50%的浓度则升至124℃,到了98%高浓度时,其沸点更是高达332℃。盐酸(HCl)在还原性介质中的最高温度可达到36~37℃,这表明盐酸的稳定性在这一温度范围内较好。
盐水沸点为什么比水高(盐水沸点高还是清水沸点高)
盐水沸点为什么比水高。盐水的沸点随盐的浓度而变,当盐度每升高1%时,则盐水沸点温度升高0.16℃,10%浓度的盐水沸点大约在106℃。在标准大气压下,盐水的沸点总是高于水,氯化钠很容易溶于水,同时分解成钠离子和氯离子,并且在液体的内部扩散开来。
在标准大气压下,盐水的沸点比清水的沸点高是因为盐水的分子比清水的分子更易结合在一起,从而改变了水的分子结构,使得盐水分子之间的作用力增大,从而提高了盐水的沸点。
当水分子想要转变为水蒸气时,它们需要摆脱周围水分子以及钠离子和氯离子的吸引和束缚。因此,与纯水相比,盐水需要更多的能量来实现这一转变。这意味着,在盐水环境中,产生水蒸气所需的温度要高于纯水,因此,盐水沸腾的温度也相应较高。这种差异在日常生活和自然界中都有明显的体现。
水的沸点和凝固点是液体物理性质的重要方面。盐水的沸点比纯水高,这一特性在实际应用中有多种体现。例如,在103度的盐水中放置一个碗,只要盐水不浸到碗内,碗里的纯水就能在未直接接触盐水的情况下升温并达到沸点。这种方法称为浴热法,常用于提升液体的温度。
是由于溶解固体后,水的浓度降低,水的蒸汽压就降低,此时要使水的蒸汽压达到1个标准大气压,就需要提高温度来满足,因此水的沸点就升高。
氨水浓度密度对照表
1、氨水浓度密度对照表如下:氨水浓度%、密度、氨水浓度%、密度、氨水浓度%、密度、氨水浓度%、密度。250.902240.89630.891390.8864。260.902240.89630.891300.8862。
2、氨水浓度密度对照表答案如下:密度:氨水的密度通常在0.9-0.98g/mL范围内,取决于浓度。浓度:氨水的浓度可以以质量分数(w/w),体积分数(v/v)或摩尔分数(molar)来表示。
3、氨水又称阿摩尼亚水,主要成分为NH3·H2O,是氨气的水溶液,无色透明且具有刺激性气味。熔点-77℃,沸点36℃,密度0.91g/cm^3。易溶于水、乙醇。易挥发,具有部分碱的通性,由氨气通入水中制得。有毒,对眼、鼻、皮肤有刺激性和腐蚀性,能使人窒息,空气中最高容许浓度30mg/m^3。
乙醇温度密度对照表国家标准
乙醇的密度是多少? —— 40℃,56kJ/(kg·℃)50℃,67kJ/(kg·℃)60℃,78kJ/(kg·℃)乙醇在常温常压下是一种易燃、易挥发的无色透明液体,低毒性,纯液体不可直接饮用;具有特殊香味,并略带刺激;微甘,并伴有刺激的辛辣滋味。
无水乙醇(无水酒精)在标准状态下的相对密度为0.7893。35度时乙醇密度: 0.77641g/cm3 乙醇(酒精)在标准状态下的密度为0.79 无水乙醇(无水酒精)在标准状态下的密度为0.7893。
下表为20℃下乙醇与水的混合液体的密度(以乙醇的体积分数为变量):乙醇的溶解性:能与水以任意比互溶;可混溶于醚、氯仿、甲醇、丙酮、甘油等多数有机溶剂。
水在不同负压下的沸点
1、在标准大气压下,水的沸点是100摄氏度。 当压力低于1atm时,水的沸点会降低,小于100摄氏度。 在压力为0.7atm的环境中,水的沸点为90摄氏度。 压力降至0.3atm时,水的沸点进一步下降至70摄氏度。 而在0.1atm的压力下,水的沸点仅为40摄氏度。
2、在一个大气压下,为100摄氏度。在压力低于1atm时,水的沸点就低于100摄氏度。压力为0.7 atm时,沸点为90摄氏度。压力为0.3atm时,沸点为70摄氏度。压力为0.1 atm时,沸点为40摄氏度。沸腾是在一定温度下液体内部和表面同时发生的剧烈汽化现象。
3、在一个大气压下,为100摄氏度。在压力低于1atm时,水的沸点就低于100摄氏度:压力为0.7 atm时,沸点为90摄氏度;压力为0.3atm时,沸点为70摄氏度;压力为0.1 atm时,沸点为40摄氏度;。
4、在常压下,水的沸点是100摄氏度。然而,当压力发生变化时,水的沸点也会相应改变。例如,在5kp(千帕斯卡)的条件下,水的沸点会低于100摄氏度。为了准确计算水在不同压力条件下的沸点,可以采用拉乌尔定律或者克劳修斯-克拉贝龙方程。
溴化氢沸点
1、化氢水溶液的沸点取决于溴化氢的浓度。当溴化氢的浓度为0时,溴化氢水溶液的沸点为100℃;当溴化氢的浓度达到14%时,溴化氢水溶液的沸点为112℃;当溴化氢的浓度达到38%时,溴化氢水溶液的沸点为130.4℃。
2、在HF、HI、HBr、HCl这四种氢卤酸中,沸点从高到低的顺序是:HI(碘化氢) HBr(溴化氢) HCl(氯化氢) HF(氟化氢)原因:分子大小和分子间力:氢卤酸的沸点主要受分子间作用力(如氢键、范德华力等)的影响。随着卤素原子从氯到碘的增大,分子间的范德华力也增加,导致沸点升高。
3、HF(氢氟酸)的熔点为-865摄氏度,而HCl(盐酸)的熔点为-112摄氏度。 HBr(溴化氢)的熔点为-89摄氏度,HI(碘化氢)的熔点为-50.8摄氏度。 在沸点方面,HF的沸点为15摄氏度,HCl的沸点为-81摄氏度。 HBr的沸点为-61摄氏度,HI的沸点为-31摄氏度。
4、例如,氟化氢(HF)的熔点约为-89℃,沸点约为15℃;氯化氢(HCl)的熔点约为-112℃,沸点约为-80℃;溴化氢(HBr)的熔点约为-85℃,沸点约为-60℃;碘化氢(HI)的熔点约为-50.8℃,沸点约为14℃。可以看出,随着原子序数的增加,氢化物的熔沸点逐渐升高。
5、溴化氢的沸点为-68℃,是一种无色且具有辛辣刺激气味的气体。其相对密度为71(空气=1),危险性标记为6(有毒气体)、41(腐蚀品)。在常温下,溴化氢的蒸汽压为532kPa(-70℃),熔点为-89℃。它能与水、乙醇等物质易溶,稳定性良好。