为什么还原氢气还原电势要大于零
1、常用的氢电极有标准氢电极,电势为0,不随pH变化,所以是0V。如果是可逆氢电极,pH为0时电势为0vs.SHE,电势随pH变化,当pH为10时,电势为0+0.0592*(-10)=-0.592v。
2、可逆氢电极电势大于0不析氢。在实际化学反应中,析氢反应所需的电势是小于等于0V,因此在可逆氢电极中电势大于0不析氢。当电极的电势大于0V时,表示电极的氧化反应更容易发生,而还原反应(析氢)的发生则更困难。
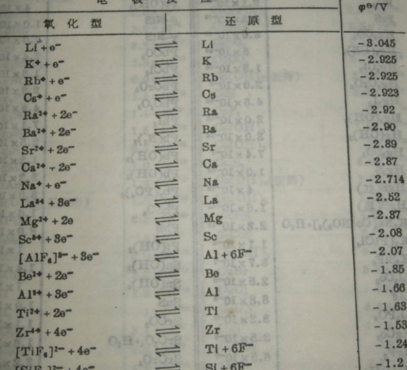
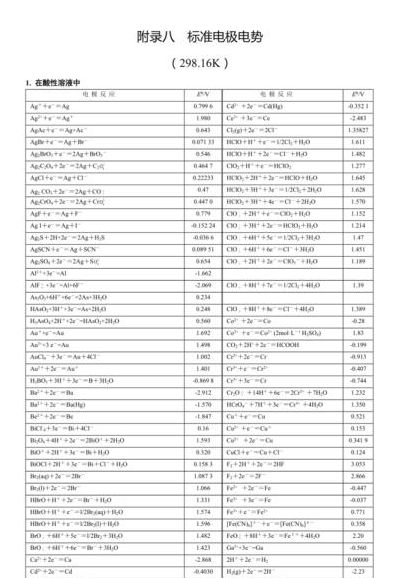
3、每对标准电极电势越高,高价物质的氧化性越强,对应低价物质还原性越弱;标准电极电势越低,高价物质的氧化性越弱,对应低价物质还原性越强。
还原电势越负意味着什么
您对这个例子的观察是正确的。根据标准电极电势的定义,正电极电势越大,表示该物种越容易被还原,即具有更强的还原性。相反,负电极电势越大,表示该物种越容易被氧化,即具有更强的氧化性。
氧化还原电位越负,越倾向于发生氧化反应;氧化还原电位越正,越倾向于发生还原反应。
氧化还原电位是用来反映水溶液中所有物质表现出来的宏观氧化-还原性。氧化还原电位越高,氧化性越强,电位越低,氧化性越弱。电位为正表示溶液显示出一定的氧化性,为负则说明溶液显示出还原性。
如何理解还原性电极电势的大小顺序呢?
1、E值越小(例如Li:-03v)的电极其还原型物质愈易失去电子,是愈强的还原剂,对应的氧化型物质则愈难得到电子,是愈弱的氧化剂。
2、在一般应用中,氧化还原电位和电极电势两个名词混用。 氧化还原电位越负,越倾向于发生氧化反应;氧化还原电位越正,越倾向于发生还原反应。
3、标准电极电势的数值越大,它的氧化态的氧化性越强,还原态的还原性越弱;标准电极电势的数值越小,它的氧化态的氧化性越弱,还原态的还原性越强。
还原电势f的比h的大吗
H的相对电负性是1,Cl是0,相差不大,H与Cl生成HCl分子时,形成的电子对是共用的,但偏向Cl原子,形成共价键,H显共价键+1价,Cl显共价键-1价。
碘离子,溴离子以及二价铁离子,它们都是还原性电极电位,而溴单质,碘单质三价铁它们都是氧化性电极电位。实际上就是比氧化性,标准状况下氧化性大的标准电极电势大。Br2Fe3+Fe2+Br-。学好化学:课堂笔记。
E值越小(例如Li:-03v)的电极其还原型物质愈易失去电子,是愈强的还原剂,对应的氧化型物质则愈难得到电子,是愈弱的氧化剂。
F的电负性比O大而H电负性比O小,负电荷主要在两对孤对电子处,这是H2O和OF2有极性的主要原因。