电离程度怎么判断口诀
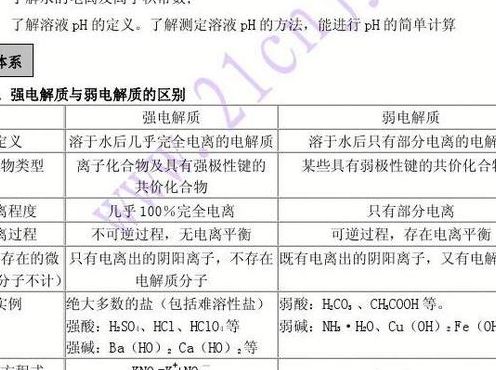
具有离子键与强极性键的化合物是强电解质;盐类、强碱、强酸是强电解质;具有弱极性共价键的化合物是弱电解质;弱酸弱碱是弱电解质。拓展知识 电离度是表示弱电解质在水中电离程度的物理量。
电离程度怎么判断:根据电离常数的大小判断,若电离常数大,能该物质在标准状态下的电离程度就大。电离程度 电离程度就是分子在水中的电离的百分比。弱电解质的浓度增大后电离的百分比下降即电离程度下降。
电解质强弱的判断口诀:具有离子键与强极性键的化合物是强电解质;盐类、强碱、强酸是强电解质;具有弱极性共价键的化合物是弱电解质;弱酸弱碱是弱电解质。电解质是溶于水溶液中或在熔融状态下就能够导电的化合物。
熔化或者溶解。能导电。化合物。强弱电解质可以从如下三个方面来判断:电离程度。化学键。化合物属类。电解质是溶于水溶液中或在熔融状态下就能够导电的化合物。
判断电解质口诀 综合上所述,强弱电解质可以从电离程度、化学键、化合物属类三个方面来判断,此外,区分强弱电解质的三要素是熔化、能导电、化合物。
K是一个只与温度有关的函数,lgK=A-B/T(A、B均为常数),由表达式可知,当温度升高时,电离平衡常数增大,即电离程度增大,反之减小,而温度不变,任何浓度下的电离常数不变,所以温度是电离程度的一个判断因素。
电离度是什么意思?
电离度——弱电解质在溶液里达电离平衡时,已电离的电解质分数占原来总分子数(包括已电离的和未电离的)的百分数。
电离度的词语解释是:当弱电解质达到电离平衡时,溶液中电解质已电离的分子数占原总分子数的百分比。一般电解质越弱,电离度越小。对于同一种电解质,通常溶液的浓度越小,电离度越大;温度升高,电离度增大。
即电离度表示弱酸、弱碱在溶液中离解的程度。
电离度就是衡量电离的Na+(或者Cl-)离子,占溶解的NaCl的比例。NaCl是强电解质,所以几乎溶解的NaCl全部电离,就是说溶液中,理论上,没有NaCl分子。
电离常数又叫电离平衡常数,用Ki表示。如醋酸,碳酸和硼酸。其定义为,当弱电解质电离达到平衡时,电离的离子浓度的乘积与未电离的分子浓度的比值叫做该弱电解质的电离平衡常数。
电离程度与什么有关
1、温度:电离过程是吸热过程,温度升高,平衡向电离方向移动。浓度:弱电解质浓度越大,电离程度越小。
2、一般情况下,物理学中电离与温度、电压、化学反应等因素有关。温度非常高时,电子和原子核可以分开成为等离子体,如太阳内部的核聚变反应。当电压很高时,就可以产生放电,在电流的路径上,物质会产生电离,形成等离子体。
3、电离度——弱电解质在溶液里达电离平衡时,已电离的电解质分子数占原来总分子数(包括已电离的和未电离的)的百分数。即电离度表示弱酸、弱碱在溶液中离解的程度。
4、与温度、酸碱、活泼金属有关。温度。升温总是促进水的电离。一般情况,酸和碱抑制水的电离。某些酸或碱,如硼酸,羟胺等,能促进水的电离。能水解的盐,盐类(除酸式盐之外)总是促进水的电离。活泼金属。
5、温度、浓度和溶液中已有离子 温度高易电离,浓度小易电离,溶液中已有离子如果和电离出的离子反应易电离。