什么是道尔顿定律?
混合气体的分压定律即道尔顿分压定律:低压下气体混合物的总压等于组成该气体混合物的各组分的分压力之和,这个定律称为道尔顿分压定律。
道尔顿分压定律(也称道尔顿定律)描述的是理想气体的特性。这一经验定律是在1801年由约翰·道尔顿所观察得到的。
道尔顿分压定律(也称 道尔顿定律)描述的是 理想气体的特性。一定量的气体在一定容积的容器中的 压强仅与温度有关。理想气体混合物中某一组分B的分压等于该组分单独存在于混合气体的温度T及总体积V的条件下所具有的压力。
道尔顿分压定律如下称为道尔顿定律或气体分压定律,是在混合气体中,各个组分分子的压强与其分数成正比的定律。该定律由英国化学家约翰·道尔顿于1803年提出,对于理解气体混合物中各个组分的行为和性质非常重要。
分压定律的应用
1、道尔顿分压定律(也称道尔顿定律)描述的是理想气体的特性。这一经验定律是在1801年由约翰·道尔顿所观察得到的。其描述如下:在组分之间不发生化学反应的前提下,理想气体混合物的总压力等于各组分的分压力之和。
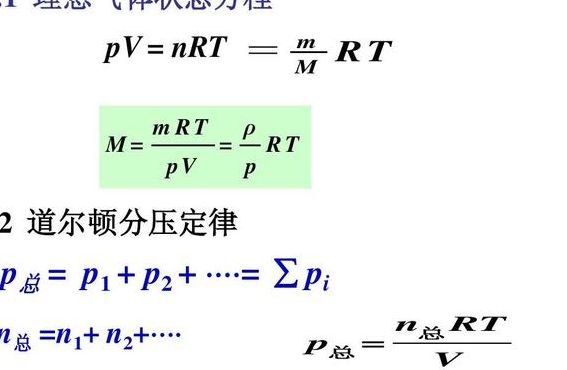
2、:混合气体中各组分气体的分压之和等于混合气体的总压。数学表达式:p=p1+p2+p3+...2:当混合气体个组分之间不发生反应时,理想气体定律同样适用于气体混合物,此时将混合气体作为一个整体。
3、分压定律的应用条件是道耳顿分压定律只适用于混合的理想气体,对于实际气体,此定律只在压强较低时才近似地成立。
4、分压定律共有两种表达方式 混合气体中各组分气体的分压之和等于混合气体的总压。数学表达式:p=p1+p2+P3+...当混合气体个组分之间不发生反应时,理想气体定律同样适用于气体混合物,此时将混合气体作为一个整体。
5、分压定理是指在电路中,当一个电阻的电压与另一个电阻的电压相同时,这两个电阻之间的电流将相互抵消。这个定理可以用数学公式表示为:U1/R1=U2/R2。其中,U1和U2是两个电阻上的电压,R1和R2是两个电阻的阻值。
分压定律是?
混合气体的分压定律即道尔顿分压定律:低压下气体混合物的总压等于组成该气体混合物的各组分的分压力之和,这个定律称为道尔顿分压定律。
分压定律是约翰·道尔顿观察提出的定律,气体的特性是能够均匀地布满它所占有的全部空间,因此,在任何容器的气体混合物中只要不发生化学变化,就像单独存在的气体一样,每一种气体都是均匀地分布在整个容器之中。
道尔顿分压定律(也称 道尔顿定律)描述的是 理想气体的特性。一定量的气体在一定容积的容器中的 压强仅与温度有关。理想气体混合物中某一组分B的分压等于该组分单独存在于混合气体的温度T及总体积V的条件下所具有的压力。
道尔顿分压定律是指在气体混合物中,每种气体的分压等于该气体在混合物中所占比例乘以总压力。这个定律可以用来计算气体混合物中每种气体的分压,从而得到混合物的物理性质。
道尔顿分压定律 英国科学家约翰·道尔顿在19世纪初把原子假说引入了科学主流。他所提供的关键的学说,使化学领域自那时以来有了巨大的进展。
即理想气体混合物中某一组分B的分压等于该组分单独存在于混合气体的温度T及总体积V的条件下所具有的压力。而混合气体的总压即等于各组分单独存在于混合气体温度、体积条件下产生压力的总和。这即为道尔顿分压定律。
道尔顿分压定律(气体混合物中分压的计算方法)
1、道尔顿分压定律公式:f=G/nF。道尔顿分压定律(也称道尔顿定律)描述的是理想气体的特性。这一经验定律是在1801年由约翰·道尔顿所观察得到的。
2、道尔顿分压定律是指混合气体中某一组分的分压等于该组分的质量与混合气体总质量的比值乘以混合气体的总压强。
3、例如10325kPa的干燥空气中,氮的分压是7193kPa,氧的分压是2198kPa。混合理想气体的总压强等于各组分的分压强的和,称道尔顿分压定律(J.Dalton,1766~1844,英)。
4、p=p1+p2+…=∑pi。几种气体组成的混合物,是工程上常用的工质。混合气体通常被当作理想气体研究。道尔顿分压定律,混合气体的总压力p等于其中各组成气体分压力之和。
道尔顿分压定律
道尔顿分压定律(也称 道尔顿定律)描述的是 理想气体的特性。一定量的气体在一定容积的容器中的 压强仅与温度有关。理想气体混合物中某一组分B的分压等于该组分单独存在于混合气体的温度T及总体积V的条件下所具有的压力。
在恒温时,混合气体中某组分气体都占据与混合气体相同体积时对容器所产生的压强,叫做该组分气体的分压,用Pi表示 。
分压定律是由约翰·道尔顿观察提出的定律,具体是气体的特性是能够均匀地布满它所占有的全部空间,因此,在任何容器的气体混合物中只要不发生化学变化,就像单独存在的气体一样,每一种气体都是均匀地分布在整个容器之中。
道尔顿定律又称混合气体分压定律,是由英国化学家和物理学家道尔顿(J.John Dalton)提出来的。该定律表明了各组分气体压力的相互独立和可线性叠加的性质,即相互不起化学作用的混合气体的总压力等于各组成气体分压力之和。
道尔顿分压定律的公式 道尔顿分压定律的公式为:P1=X1×P,其中P1是混合物中第一种气体的分压,X1是第一种气体在混合物中所占的比例,P是混合物的总压力。