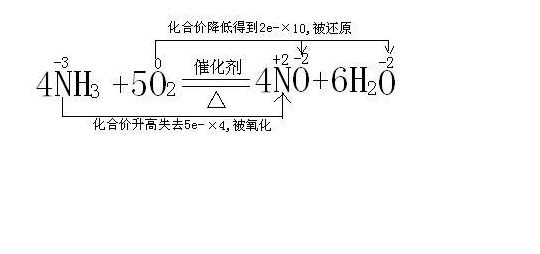
氨气的催化氧化为什么会生成一氧化氮
1、第二种情况是4NH3g+5O2g=4NOg+6H2Ol达到化学平衡时若增加容器体积,压强不变,那麽就相当于体积不变,压强减小。又因为反应前气体体积小于反应后气体体积【4+54】,所以平衡应向气体体积增大的方向进行,即平衡向逆反应方向进行。
2、实验室:二氧化氮氧化性比氧气更强,强氧化剂制弱氧化剂,催化氧化的温度使二氧化氮分解成一氧化氮和氧气。工业上是可以合成NO2的。别理解那么多,就记住“氨气和氧气反应生成一氧化氮”就完了。
3、这个反应之所以生成氮气和水,要从反应物氨气和一氧化氮自身的性质以及反应历程开始讨论。 首先,氨气分子中电负性大的氮原子与电负性小的氢原子形成三个极性共价键,那么氮原子必然由此变成一个-3价的中心原子。
为什么用氦气作为检漏的气体?
因为氦气的化学性质稳定,无害。通常密闭设备(如铠装电缆),可以充入气体检漏,如果能正常保持压力,证明无漏点,如果泄压(压力迅速减小),证明有漏点。
由于氦气渗透性(灵敏度)好,安全性高,因此氦气很适用于漏率检测。
氮原子外电子层有5个电子,未达到8电子的稳定状态。而氦原子的外围已达到2电子的稳定状态,其化学特性稳定,不易爆炸。
粗检漏是用于发现较大的泄漏。如果这一关过了就进入细检漏程序。氦气是一种渗透能力非常强的气体,在压力下可以渗入金属的缝隙(实际上在压氦气之前还要抽真空)。压完氦气后要用氮气将被测物表面残留的氦气吹掉,再放入质谱仪内抽真空检测。
什么与氧气反应生成一氧化氮(不是氮气)
1、氨气可以在纯氧中燃烧生成氮气和水4NH3+3O2==点燃==2N2+6H2O 氨气也可以被一些金属氧化物氧化为氮气3CuO+2NH3 ==加热==3Cu+3H2O+N2 氨气还可以被氯气氧化为氮气2NH3+3Cl2=N2+6HCl 而氨的催化氧化使用的是空气不是纯氧,所以需要催化剂,产物为一氧化氮。
2、氨水和氧气反应生成一氧化氮。一氧化氮为氮氧化合物,化学式NO,相对分子质量30.01,氮的化合价为+2。是一种无色无味气体难溶于水的有毒气体。由于一氧化氮带有自由基,这使它的化学性质非常活泼。当它与氧气反应后,可形成具有腐蚀性的气体——二氧化氮(NO2),二氧化氮可与水反应生成硝酸。
3、氨气与氧气用铂铑合金催化氧化得到一氧化氮和水。(动力学因素)氨气在纯氧中燃烧生成氮气和水--好像是因为一氧化氮在热力学上远不如氮气单质稳定。在高温时会分解成氮气和氢气,有还原作用。有催化剂存在时可被氧化成一氧化氮。用于制液氮、氨水、硝酸、铵盐和胺类等。
4、氮气是一种非常稳定的气体 工业合成硝酸 氨氧化法 硝酸工业与合成氨工业密接相关,氨氧化法是工业生产中制取硝 浓硝酸 酸的主要途径,其主要流程是将氨和空气的混合气(氧:氮≈2:1)通入灼热(760~840℃)的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮(NO)。
5、NaNO2+H2SO4(稀)→2NO↑+NaNO3+Na2SO4+H2O 一氧化氮是氮的化合物,化学式NO,分子量30,氮的化合价为+2。由于一氧化氮带有自由基,这使它个化学性质非常活泼,具有顺磁性。当它与氧反应后,可形成具有腐蚀性的气体——二氧化氮(NO2)。一氧化氮在标准状况下为无色气体,液态、固态呈蓝色。
6、一氧化氮与氧气反应:一氧化氮和氧气极易发生反应,但反应速率较慢。方程式:2NO+O2===2NO2。该反应在计算时可认为是不可逆的。一氧化氮与氧气的联系:一氧化氮和氧气之间存在拮抗作用,即两者之间存在着相互抑制的关系。在化学反应中,一氧化氮和氧气会发生氧化还原反应,生成二氧化氮。
氨气与什么反应生成了一氧化氮?
NH3+5O2=4NO+6H2O(催化剂/加热)分析:氨气加氧气,在催化剂条件下加热,可生成一氧化氮和水。氨气检验方法:用湿润的红色石蕊试纸检验,试纸变蓝证明有氨气。用玻璃棒蘸浓盐酸靠近,产生白烟,证明有氨气。氨气检测仪表可以定量测量空气中氨气的浓度。
氨气与氧气用铂铑合金催化氧化得到一氧化氮和水。(动力学因素)氨气在纯氧中燃烧生成氮气和水--好像是因为一氧化氮在热力学上远不如氮气单质稳定。在高温时会分解成氮气和氢气,有还原作用。有催化剂存在时可被氧化成一氧化氮。用于制液氮、氨水、硝酸、铵盐和胺类等。
NH3g+5O2g=4NOg+6H2Og达到化学平衡时若增加容器体积,那麽就相当于体积不变,压强减小。又因为反应前气体体积小于反应后气体体积【4+54+6】,所以平衡应向气体体积增大的方向进行,即平衡向正反应方向进行。
氨气可以有催化剂,加热的条件下被氧气氧化,反应方程式为:4NH3+5O2=4NO+6H2O,在等号上写催化剂,等号下画三角符号(加热)。即4摩尔的氨气在加热催化剂条件下被5摩尔氧气氧化为4摩尔一氧化氮和6摩尔水。如果还有什么不清楚的可以提问,希望我能帮到你,谢谢。
氨气和二氧化氮都是无色气体,但它们反应后会生成一种红棕色的气体——一氧化氮。这个反应的化学方程式可以表示为:2NH3+2NO2→2NO+N2+3H2O。这个反应在工业上也有着广泛的应用。例如,在生产硝酸的过程中,需要使用氨气和二氧化氮作为原料。这些化合物在高温下反应会生成硝酸和氮气。
氨气催化氧化反应方程式是:4NH+5O→4NO+6HO。这个反应是在铂铑合金等催化剂存在的条件下,氨气和氧气发生氧化还原反应生成一氧化氮和水的过程。这个反应是工业上制备硝酸的重要步骤之一,也是工业上常用的制氮方法之一。