4大临床试验查询平台:查遍全球所有的临床试验信息,教你如何入组临床试验...
国家食品药品监督管理总局临床试验信息平台,包含中国所有阶段的临床试验,可通过cde.org.cn网站查询。搜索时,使用简练且相关的关键字,如疾病或药品名,高级查询功能可帮助细化筛选。具体步骤包括输入检索词,选择查询字段,如适应症、试验状态等。
在国内,您可以访问中国临床试验注册中心(ChiCTR),这是查询国内临床试验的重要入口。对于全球范围的试验,推荐使用两个常用的查询平台:世界卫生组织(WHO)国际临床试验注册平台(ICTRP),这是科研人员和患者广泛参考的国际信息平台。以上资源可供您在选择参与或了解临床试验时提供参考。
保存一份患者诊断目录(Diagnostic Index,DI)是用于筛查受试者参加某项试验资格的另一个有效方法。DI是一个简单记录有患者姓名和特点的文档或计算机系统,通过输入符合入组条件的一些关键词,在此系统中搜索可用于筛选的患者。虽然使用DI省时方便,但对于进行常规试验的研究者来讲并不是一个有效的方法。
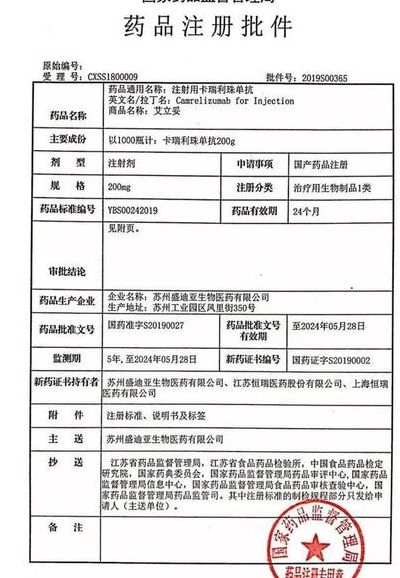
在按登记号浏览中点击“登记号”进入详情页面包含基本信息、临床时间轴、申办单位信息、临床试验信息、研究者信息、伦理委员会信息、临床试验结果摘要、其他信息。
临床注册号可以用于多篇文章吗
临床注册号可以用于多篇文章。根据查询相关公开信息得:临床试验注册号应是从世界卫生组织认证的一级临床试验注册中心获得的全球唯一的注册号,是可以多篇文章使用的。临床是指直接接触病人,对病人进行实际的观察。如内科学、外科学、妇产科学、儿科学等学科属于临床医学。
临床试验注册号编排印在摘要结尾处,以“临床试验注册”为标题(字体、字号以摘要其他小标题相同),写出注册机构名称和注册号。
微信公众号来说还是比较普遍的,在公众号可以发一些文章信息之类的。
微信公众号开通的服务号,如果是个人号一天可以发布一篇文章,公司号一周可以发布一篇文章。微信服务号发文章的方法:登录到微信公众号中,然后才能进行编辑,先输入账号和密码这样就能够登录了。在微信公众号页面的左侧栏中找到一个素材管理按钮,然后点击进入。
临床试验——注册临床注册号
注册流程包括创建注册账户、填写详细申请表格,其中伦理审查批件和病人知情同意书是必需的。伦理审查应在注册前后进行,具体时间取决于伦理委员会的要求。
临床注册号可以用于多篇文章。根据查询相关公开信息得:临床试验注册号应是从世界卫生组织认证的一级临床试验注册中心获得的全球唯一的注册号,是可以多篇文章使用的。临床是指直接接触病人,对病人进行实际的观察。如内科学、外科学、妇产科学、儿科学等学科属于临床医学。
在摘要结尾处。临床试验注册号编排印在摘要结尾处,以临床试验注册为标题(字体、字号以摘要其他小标题相同),写出注册机构名称和注册号。
选择临床试验注册平台:国际上常用的临床试验注册平台有ClinicalTrials.gov、WHOInternationalClinicalTrialsRegistryPlatform(ICTRP)等,国内常用的有中国临床试验注册中心(ChiCTR)、中国医学科学院临床试验注册中心(CCTR)等。根据自己的需求选择合适的平台。
临床试验注册的途径如下:全部注册程序均为在线申报,中国临床试验注册中心网址:http://。首先,登录中国临床试验注册中心网站:http:// 建立申请者账户:点击ChiCTR首页右侧的用户登录区的“新用户注册”。
临床试验注册(加强临床研究透明度和公正性)
1、临床试验注册是指将计划进行的临床试验信息公开注册在国际或本国的临床试验注册平台上,以增加临床试验的透明度和公正性。临床试验的注册是临床试验管理的重要环节,也是保障受试者权益和试验结果可信度的重要措施。
2、临床试验注册是医学研究伦理的需要,是临床试验研究者的责任和义务。促进透明度和科学道德:试验注册能够确保研究人员提供全面、准确的试验信息,避免隐藏或选择性报道结果。这种透明度有助于防止科学不端行为,维护研究的科学道德和诚信。
3、通过试验注册,可以提高临床试验的透明度,避免重复试验和不公正的选择性报告。同时,试验注册还有助于监管机构、研究者和公众更好地了解正在进行的临床试验,以便更好地评估其可靠性和结果的解释性。
4、他在临床流行病学和循证医学领域扮演了重要角色,参与了多项国家级科研项目,并提出了关于高碘甲肿和大骨节病病因的理论,如“脱碘酶功能障碍学说”。他的工作推动了我国临床试验注册制度的实施,提升了临床试验的透明度,对我国临床研究规范化管理有着深远影响。
5、临床研究。先是临床研究,然后临床试验,最后申报注册。临床试验只是临床研究的一小部分,临床试验是临床研究,但临床研究绝不等于临床试验。
6、临床试验注册以后实施过程不可以不一样。临床试验注册的目的是为了公开和透明临床试验的设计方案,让研究人员、医学专业人员和患者都能了解到试验的目的、方法、参与者、研究计划和结果等信息,并防止试验结果的不公正性和不完整性。因此,注册信息应当真实、准确和完整,试验的实施过程应与注册信息一致。
临床试验和注册研究的区别
1、临床试验和注册研究的区别有研究目的不同和研究人群不同等。研究目的不同:临床试验是为了评价一种治疗方法的安全性和有效性而进行的研究,通常包括前期试验、安全性和有效性试验等;而注册研究则是为了评估药物或治疗方法是否适合在人群中广泛应用,以便药物获批上市或新的治疗方法得到临床认可。
2、临床研究。先是临床研究,然后临床试验,最后申报注册。临床试验只是临床研究的一小部分,临床试验是临床研究,但临床研究绝不等于临床试验。
3、商标。首先注册商标是取得商标专用权的前提,注册商标才能受到法律保护。其次非注册类临床试验是指已上市的药物、医疗器械和诊断试剂等涉及人体的临床研究,最后非注册目的不是申请CFDA注册,无需提供CFDA批件,注册研究是要取得cfda的批准才可以进行。
临床试验注册可以撤销吗
1、可以。根据国家食品药品监督管理总局关于药物临床试验数据自查核查撤回注册申请情况的公告显示,临床试验注册申请的申请人可以主动撤销,对于主动撤销的可按新的要求重新组织开展临床试验。所有的临床试验均应注册,包括干预性和观察性研究。
2、注册申请撤回后,药品注册申请人拟重新开展或者补充完善临床试验的,原药物临床试验批件继续有效。药品注册申请人重新开展临床试验的,应当在第1例受试者入组前在国家食品药品监督管理总局药物临床试验登记与信息公示平台按要求完成开展试验前的所有信息登记。
3、撤销。临床试验走医保了可以撤销,向参保地医保部门咨询。试验期间内发生的所有费用,都不纳入医保报销的范畴。
4、第二十九条 有下列情形之一的,国家食品药品监督管理总局应当撤销已获得的医疗器械临床试验批准文件: (一)临床试验申报资料虚假的; (二)已有最新研究证实原批准的临床试验伦理性和科学性存在问题的; (三)其他应当撤销的情形。