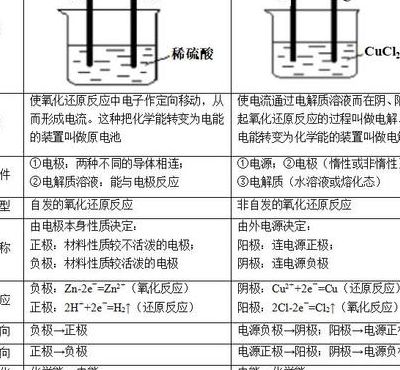
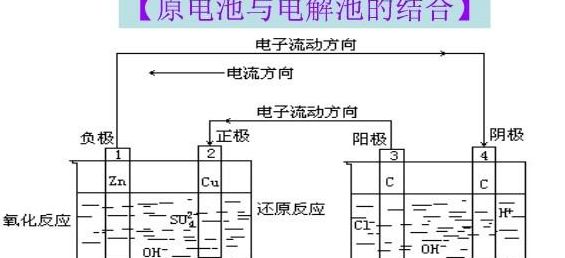
简要比较原电池和电解池的异同点
1、能量转换不同 原电池是把化学能转变成电能的装置,而电解池是将电能转换成为化学能的装置。原理不同 原电池反应的原理是还原剂在负极上失电子发生氧化反应,电子通过外电路输送到正极上,氧化剂在正极上得电子发生还原反应,从而完成还原剂和氧化剂之间电子的转移,产生电流。
2、两者区别有本质区别、装置区别、电子流向区别。本质区别:原电池是把化学能转化为电能;电解池是把电能转化为化学能。装置区别:原电池没有外加电源;电解池有外加电源。电子流向区别:原电池的电子流向刚好跟电流的方向相反;电解池刚好跟原电池的电子流向相反。
3、电解池与原电池装置的区别:电解池有外加电源;原电池没有外加电源。电解池与原电池电子流向的区别:原电池的电子流向刚好跟电流的方向相反(电流正电荷流向,电子带负电);电解池刚好跟原电池的电子流向相反(电子经负极流出到电解池中)。
4、区别有电能装置不同,使用领域不同。原电池是一种将化学能转化为电能的装置,由两个电极和一个电解质组成。在原电池中,化学反应会产生电子流动,从而产生电流。而电解池是一种将电能转化为化学能的装置,由两个电极和一个电解质组成。
5、电解池与原电池装置的区别,电解池有外加电源,原电池没有外加电源。原电池的电子流向刚好跟电流的方向相反,电流正电荷流向,电子带负电。电解池刚好跟原电池的电子流向相反,电子经负极流出到电解池中。注意事项的是含氧酸水的电解,活泼性金属的含氧酸盐也是水的电解。
电解池和原电池的区别
电解池和原电池的区别:电解池与原电池的本质区别:电解池是把电能转化为化学能;原电池是把化学能转化为电能。电解池与原电池装置的区别:电解池有外加电源;原电池没有外加电源。
能量转换不同 原电池是把化学能转变成电能的装置,而电解池是将电能转换成为化学能的装置。原理不同 原电池反应的原理是还原剂在负极上失电子发生氧化反应,电子通过外电路输送到正极上,氧化剂在正极上得电子发生还原反应,从而完成还原剂和氧化剂之间电子的转移,产生电流。
电解池与原电池的本质区别,电解池是把电能转化为化学能,原电池是把化学能转化为电能。电解池与原电池装置的区别,电解池有外加电源,原电池没有外加电源。原电池的电子流向刚好跟电流的方向相反,电流正电荷流向,电子带负电。电解池刚好跟原电池的电子流向相反,电子经负极流出到电解池中。
结构上的区别:原电池是由两个半反应组成的,一个是氧化还原反应,另一个是非氧化还原反应。原电池通常由正极、负极和电解质组成。正极是氧化剂发生还原反应的地方,负极是还原剂发生氧化反应的地方,电解质则是连接正负极的导电介质。原电池的结构相对简单,通常是一个封闭的系统。
原电池与电解池的区别与联系
原电池是将化学能转化为电能的装置。 电解池将电能转换为化学能 原电池与电解池 原电池形成三条件: “三看”。先看电极:两极为导体且活泼性不同;再看溶液:两极插入电解质溶液中;三看回路:形成闭合回路或两极接触。
能量转换不同 原电池是把化学能转变成电能的装置,而电解池是将电能转换成为化学能的装置。原理不同 原电池反应的原理是还原剂在负极上失电子发生氧化反应,电子通过外电路输送到正极上,氧化剂在正极上得电子发生还原反应,从而完成还原剂和氧化剂之间电子的转移,产生电流。
电解池与原电池的本质区别,电解池是把电能转化为化学能,原电池是把化学能转化为电能。电解池与原电池装置的区别,电解池有外加电源,原电池没有外加电源。原电池的电子流向刚好跟电流的方向相反,电流正电荷流向,电子带负电。电解池刚好跟原电池的电子流向相反,电子经负极流出到电解池中。
原电池和电解池的区别:本质不同、装置不同、电子流向不同、应用不同、电池级不同、电的形式不同。本质不同:电解池是把电能转化为化学能;原电池是把化学能转化为电能。装置不同:电解池有外加电源;原电池没有外加电源。
原电池与电解池都是能量转换装置,但它们之间存在着显著的区别和联系。原电池是化学能向电能转化的设备,其工作基于特定的条件:两极需为导体且活泼性不同,插入电解质溶液中,且形成闭合回路或接触。
结构上的区别:原电池是由两个半反应组成的,一个是氧化还原反应,另一个是非氧化还原反应。原电池通常由正极、负极和电解质组成。正极是氧化剂发生还原反应的地方,负极是还原剂发生氧化反应的地方,电解质则是连接正负极的导电介质。原电池的结构相对简单,通常是一个封闭的系统。