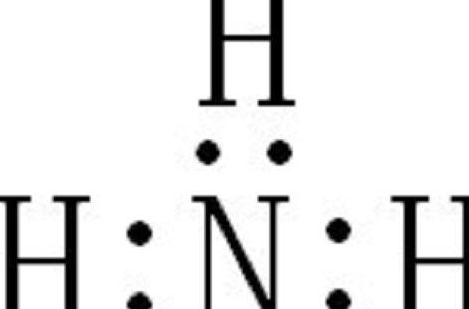求解:氨气的化学式怎么写
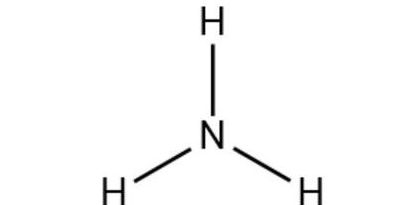
1、化学式:NH3 结构式:N / | \ H H H 为三角锥构型。
2、氨气的化学式为NH3,氨气在高温时会分解成氮气和氢气,有还原作用,有催化剂存在时可被氧化成一氧化氮,世余用于制液氮、氨水、硝酸、铵盐和胺类等。
3、 我来答 分享 微信扫一扫 网络繁忙请稍后重试 新浪微博 QQ空间 举报 浏览480 次 可选中1个或多个下面的关键词,搜索相关资料。也可直接点“搜索资料”搜索整个问题。
4、氨气化学式为NH3。氨气化学式为NH3,无色气体。有强烈的刺激气味。在高温时会分解成氮气和氢气,有还原作用。有催化剂存在时可被氧化成一氧化氮。用于制液氮、氨水、硝酸等。可由氮和氢直接合成而制得,能灼伤皮肤、眼睛、呼吸器官的黏膜,人吸入过多,能引起肺肿胀,以至死亡。
5、氨气化学式写为nh3。氨水又称阿摩尼亚水,主要成分为NH3·H2O,是氨的水溶液,无色透明且具有刺激性气味。氨的熔点-7773℃,沸点-334℃,密度0.91g/cm。知识拓展 氨水又称阿摩尼亚水,主要成分为NH3·H2O,是氨的水溶液,无色透明且具有刺激性气味。
6、氨气分子模型 氨气,无机化合物,常温下为气体,无色有刺激性恶臭的气味,易溶于水,氨溶于水时,氨分子跟水分子通过*氢键结合成一水合氨(NH3·H2O),一水合氨能小部分电离成铵离子和氢氧根离子,所以氨水显弱碱性,能使酚酞溶液变红色。氨与酸作用得可到铵盐,氨气主要用作致冷剂及制取铵盐和氮肥。
氨气的化学式是什么?
1、氨气化学式为NH3。氨气化学式为NH3,无色气体。有强烈的刺激气味。在高温时会分解成氮气和氢气,有还原作用。有催化剂存在时可被氧化成一氧化氮。用于制液氮、氨水、硝酸等。可由氮和氢直接合成而制得,能灼伤皮肤、眼睛、呼吸器官的黏膜,人吸入过多,能引起肺肿胀,以至死亡。
2、氨气的化学式为NH3,氨气在高温时会分解成氮气和氢气,有还原作用,有催化剂存在时可被氧化成一氧化氮,世余用于制液氮、氨水、硝酸、铵盐和胺类等。
3、氨气的化学式是NH。氨气是一种无机化合物,其化学式为NH。下面是对这一化学式的 化学元素组成:氨气由氮元素和氢元素组成。在氨气分子中,氮原子与三个氢原子通过共价键连接。这种分子结构使得氨气具有独特的化学性质,如碱性。
4、NH3是氨气的化学式,这是一种无色、强烈刺激气味的气体,具有明显的碱性特征。它在水中产生少量氢氧根离子,且其分子量为1031,相对密度为0.5971(相对于空气而言)。氨气在常温下可通过加压转化为液体状态,临界温度为134℃,临界压力为112大气压,沸点为-35℃。
5、氨气的化学式为NH 3 ,氨气在高温时会分解成氮气和氢气,有还原作用,有催化剂存在时可被氧化成一氧化氮,用于制液氮、氨水、硝酸、铵盐和胺类等。
氨气化学式
氨气的化学式为NH3,氨气在高温时会分解成氮气和氢气,有还原作用,有催化剂存在时可被氧化成一氧化氮,世余用于制液氮、氨水、硝酸、铵盐和胺类等。
氨气化学式为NH3。氨气化学式为NH3,无色气体。有强烈的刺激气味。在高温时会分解成氮气和氢气,有还原作用。有催化剂存在时可被氧化成一氧化氮。用于制液氮、氨水、硝酸等。可由氮和氢直接合成而制得,能灼伤皮肤、眼睛、呼吸器官的黏膜,人吸入过多,能引起肺肿胀,以至死亡。
氨气的化学式是NH而不是HN的原因是因为其分子结构和电子分布决定的。氨气是一种无机化合物,其分子结构是基于氮原子和三份氢原子的结合。从电子分布的角度来看,氮原子有三个外层电子,需要与其他原子共享电子形成化学键,而与氮原子结合的三份氢原子各提供一个电子与氮原子共享。
氨气的化学方程式如下:加热浓氨水制取:NH3·H2O==NH3↑+H2O(加热条件下)。加热固体铵盐和碱的混合物制取:2NH4Cl(固态)+Ca(OH)2(固体)=CaCl2+2NH3↑+2H2O(加热条件下)。用氮化物制取:Li3N+3H2O=3LiOH+NH3↑。氨气物理性质:氨气化学式为NH3,是无色气体,氨气有强烈的刺激气味。
二氧化碳吸收与解吸实验装置
二氧化碳吸入与解吸一体化试验设备主要应用于填料吸收塔的结构、性能、特点的学习与理解,以及填料塔操作方法的掌握。通过试验,可以测定并分析数据,加深对填料塔流体力学性能基本理论的理解。同时,设备还能帮助研究者掌握填料吸收塔的传质性能理论,测定其传质能力和传质效率,对实验数据进行处理与分析。
实验室制取二氧化碳需要的装置有锥形瓶250ml、量筒、烧杯、长颈漏斗。实验室制取二氧化碳,通常采用稀盐酸与石灰石发生反应。用集气瓶来收集二氧化碳,可以选择向上排空气法。首先检查装置的气密性,还需要准备大理石和稀盐酸来发生反应,最后用燃着的木条来验证二氧化碳是否收集满。
实验步骤:连接装置。检查气密性。在锥形瓶中装入大理石(或石灰石)从长颈漏斗中加入稀盐酸。收集气体。注意:制取二氧化碳时,不能将稀盐酸换成浓盐酸。因为浓盐酸具有挥发性,使制得的二氧化碳混有氯化氢而不纯。制取二氧化碳时,不能将稀盐酸换成稀硫酸。
二氧化碳吸收-解吸实验基于双膜模型的基本假设,气侧和液侧的吸收质A的传质速率方程可分别表达为气膜方程(1)和液膜方程(2)。这些方程中包含传质速率、两相接触面积、平均分压和浓度等参数。实验中需要注意的是,操作填料吸收塔时要确保操作条件的稳定性,防止出现液泛现象。
氨法吸收二氧化碳,得到的应该是碳酸铵或者碳酸氢铵。将得到的固体加热,并将气体通过盛有强酸的洗气装置吸收氨,即可得到二氧化碳;或者直接将固体用强酸溶解,也可以放出二氧化碳。
氨气的化学式。
1、氨气的化学式为NH3,氨气在高温时会分解成氮气和氢气,有还原作用,有催化剂存在时可被氧化成一氧化氮,世余用于制液氮、氨水、硝酸、铵盐和胺类等。
2、氨气的化学式是NH而不是HN的原因是因为其分子结构和电子分布决定的。氨气是一种无机化合物,其分子结构是基于氮原子和三份氢原子的结合。从电子分布的角度来看,氮原子有三个外层电子,需要与其他原子共享电子形成化学键,而与氮原子结合的三份氢原子各提供一个电子与氮原子共享。
3、氨气化学式为NH3,无色气体。有强烈的刺激气味。在高温时会分解成氮气和氢气,有还原作用。有催化剂存在时可被氧化成一氧化氮。用于制液氮、氨水、硝酸等。可由氮和氢直接合成而制得,能灼伤皮肤、眼睛、呼吸器官的黏膜,人吸入过多,能引起肺肿胀,以至死亡。
4、氨气化学式为NH3,是无色气体,氨气有强烈的刺激气味。密度0.7710,相对密度0.5971(空气=00),易被液化成无色的液体。在常温下加压即可使氨气液化(临界温度134℃,临界压力12兆帕,即112大气压),氨气沸点-35℃,也易被固化成雪状固体,熔点-775℃,溶于水、乙醇和乙醚。
5、 我来答 分享 微信扫一扫 网络繁忙请稍后重试 新浪微博 QQ空间 举报 浏览480 次 可选中1个或多个下面的关键词,搜索相关资料。也可直接点“搜索资料”搜索整个问题。