元素周期表各个元素的相对原子质量是多少?
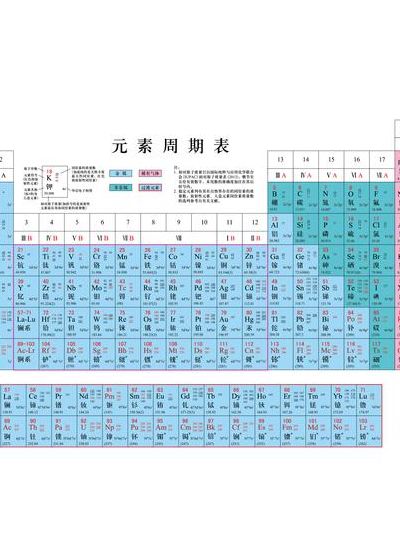
1、以上数字单位是质量数。化学元素周期表是按照原子序数排序的,原子序数=核内质子数。而相对原子质量=核子数+中子数,故会有些差额。了解相对原子质量的数值即可,无需深究精确数值。通过学习元素周期表,学生可以了解到不同元素的性质和用途,为后续化学学习打下基础。
2、所有的相对原子质量:本表数据源自2007年IUPAC元素周期表(IUPAC 2007 standard atomic weights),以 12C=12 为标准。
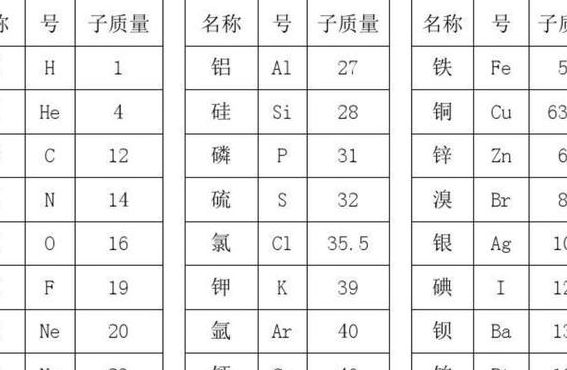
3、氦He:4 锂Li:7 铍Be:9 硼B:81 碳C:12 氮N:14 氧O:16 氟F:19 氖Ne:18 钠Na:23 镁Mg:231 铝Al:298 硅Si:209 磷P:30.97 硫S:306 氯Cl:345 氩Ar:396 钾K:310 钙Ca:40.08 以上是初中阶段常见的元素的相对原子质量。
元素周期表中元素的相对原子质量怎样排列?
氢(H)1;碳(C)12;氮(N)14;氧(O)16;钠(Na)23;镁(Mg)24;铝(Al)27;硅(Si)28;磷(P)31;硫(S)32;氯(Cl)35;钾(K)39;钙(Ca)40;锰(Mn)55;铁(Fe)56;铜(Cu)65;锌(Zn)65;银(Ag)108;钡(Ba)137;碘(I)127。
氢 H (1);碳C(12);氮N(14);氧O(16);钠Na(23);镁Mg(24);铝Al(27);硅Si(28);磷P(31);硫S(32);氯Cl(35);钾K(39);钙Ca(40);锰Mn(55);铁Fe(56);铜Cu(65);锌Zn(65);银Ag(108);钡Ba(137);碘I(127)。
首先,相对原子质量是元素周期表的基础。元素周期表是按照原子序数(核内质子数)对元素进行排序的。而相对原子质量通常接近或等于原子序数,因此相对原子质量在理解元素周期表的结构和性质上起着重要的作用。其次,相对原子质量在化学反应中扮演关键角色。在化学反应中,原子的电子变化会导致反应的发生。
元素周期表是按照元素的相对原子质量大小进行排列的。 在周期表中,原子半径随着元素从左到右的移动而减小,而从上到下的移动而增大。 具有相似化学性质的元素被放置在同一垂直列中,形成了第一张元素周期表。
元素周期表按照元素相对原子质量排列,首先观察前20号元素的特征,能默写出顺序和元素符号以及汉字书写。相对原子质量并非排布方式相关,而是以碳12原子质量为标准。例如,锂的相对原子质量虽然只有十几,而水的相对分子质量则为18。
首先,了解原子序数前缀:0、4…这有助于记忆元素周期表的前100个元素。将它们按周期和族分成不同的部分,按照从稀有到常见、从左到右的顺序排列。记住每个元素的原子序数和相对原子质量。相对原子质量是以千克为单位的,可以用字母M表示,原子序数可以用字母N表示。
化学元素周期表的每个元素的相对原子质量是多少?急!!!
1、钠(Na)的相对原子质量是23,镁(Mg)是24,铝(Al)是27,硅(Si)是28,磷(P)是31,硫(S)是32,氯(Cl)为35,氩(Ar)是40,钾(K)为39,钙(Ca)是40。这些元素的相对原子质量为化学反应和物质组成提供了重要的基础数据。过渡金属如锰(Mn)的相对原子质量是55,铁(Fe)是56。
2、所有的相对原子质量:本表数据源自2007年IUPAC元素周期表(IUPAC 2007 standard atomic weights),以 12C=12 为标准。
3、元素的相对原子质量是由其各种同位素的相对原子质量加权平均值得出的。元素周期表中最下面的数字表示相对原子质量。相对原子质量:这是一个相对数值,其比较的基准在历史上经历了多次变更。1803年,道尔顿以氢的原子量1作为基准,发布了第一张原子量表。1826年,贝采利乌斯建议以氧的原子量的1/100为基准。
4、相对原子质量在化学中扮演着重要角色。它是用来表示一个原子质量相对于碳-12原子质量的比值。这个比值能够帮助我们准确地测量其他原子的质量,并且在化学研究和实验中起到关键作用。元素周期表的排序就是基于原子序数,即核内质子数。
5、首先,相对原子质量是元素周期表的基础。元素周期表是按照原子序数(核内质子数)对元素进行排序的。而相对原子质量通常接近或等于原子序数,因此相对原子质量在理解元素周期表的结构和性质上起着重要的作用。其次,相对原子质量在化学反应中扮演关键角色。在化学反应中,原子的电子变化会导致反应的发生。
6、(4)前四周期的能级排布(1s、2s、2p、3s、3p、4s、3d、4p)。第一能层(K),只有s能级;第二能层(L),有s、p两种能级,p能级上有三个原子轨道px、py、pz,它们具有相同的能量;第三能层(M),有s、p、d三种能级。
初中常用的元素的相对原子质量表是什么?
1、初中各元素的相对原子质量表如下:氢H:1;氦He:4;锂Li:7;铍Be:9;硼B:81;碳C:12;氮N:14;氧O:1;氟F:19;氖Ne:18;钠Na:23;镁Mg:231;铝Al:298;硅Si:209;磷P:30.97;硫S:306;氯Cl:345;氩Ar:396;钾K:310;钙Ca:40.07。
2、氦He:4 锂Li:7 铍Be:9 硼B:81 碳C:12 氮N:14 氧O:16 氟F:19 氖Ne:18 钠Na:23 镁Mg:231 铝Al:298 硅Si:209 磷P:30.97 硫S:306 氯Cl:345 氩Ar:396 钾K:310 钙Ca:40.08 以上是初中阶段常用的元素的相对原子质量表。
3、常见元素相对原子质量如下:氢,符号为H,相对原子质量为007。氦,符号为He,相对原子质量为002。锂,符号为Li,相对原子质量为941。铍,符号为Be,相对原子质量为012。硼,符号为B,相对原子质量为811。碳,符号为C,相对原子质量为10107。
化学元素周期表的每个元素的相对原子质量是多少
以上数字单位是质量数。化学元素周期表是按照原子序数排序的,原子序数=核内质子数。而相对原子质量=核子数+中子数,故会有些差额。了解相对原子质量的数值即可,无需深究精确数值。通过学习元素周期表,学生可以了解到不同元素的性质和用途,为后续化学学习打下基础。
铍Be:9 硼B:81 碳C:12 氮N:14 氧O:16 氟F:19 氖Ne:18 钠Na:23 镁Mg:231 铝Al:298 硅Si:209 磷P:30.97 硫S:306 氯Cl:345 氩Ar:396 钾K:310 钙Ca:40.08 以上是初中阶段常用的元素的相对原子质量表。
钠(Na)的相对原子质量是23,镁(Mg)是24,铝(Al)是27,硅(Si)是28,磷(P)是31,硫(S)是32,氯(Cl)为35,氩(Ar)是40,钾(K)为39,钙(Ca)是40。这些元素的相对原子质量为化学反应和物质组成提供了重要的基础数据。过渡金属如锰(Mn)的相对原子质量是55,铁(Fe)是56。
元素的相对原子质量是由其各种同位素的相对原子质量加权平均值得出的。元素周期表中最下面的数字表示相对原子质量。相对原子质量:这是一个相对数值,其比较的基准在历史上经历了多次变更。1803年,道尔顿以氢的原子量1作为基准,发布了第一张原子量表。1826年,贝采利乌斯建议以氧的原子量的1/100为基准。
(4)前四周期的能级排布(1s、2s、2p、3s、3p、4s、3d、4p)。第一能层(K),只有s能级;第二能层(L),有s、p两种能级,p能级上有三个原子轨道px、py、pz,它们具有相同的能量;第三能层(M),有s、p、d三种能级。
初中化学常见元素的相对原子质量表
1、氦He:4 锂Li:7 铍Be:9 硼B:81 碳C:12 氮N:14 氧O:16 氟F:19 氖Ne:18 钠Na:23 镁Mg:231 铝Al:298 硅Si:209 磷P:30.97 硫S:306 氯Cl:345 氩Ar:396 钾K:310 钙Ca:40.08 以上是初中阶段常用的元素的相对原子质量表。
2、初中各元素的相对原子质量表如下:氢H:1;氦He:4;锂Li:7;铍Be:9;硼B:81;碳C:12;氮N:14;氧O:1;氟F:19;氖Ne:18;钠Na:23;镁Mg:231;铝Al:298;硅Si:209;磷P:30.97;硫S:306;氯Cl:345;氩Ar:396;钾K:310;钙Ca:40.07。
3、钾 K 39 ,20 钙 Ca 40 ,26 铁 Fe 56 ,29 铜 Cu 64 ,30 锌 Zn 65 ,47 银 Ag 108 ,53 碘 I 127 ,78 铂 Pt 195 ,79 金 Au 197 ,80 汞 Hg 201。本相对原子质量表按照原子序数排列。
4、氢H:1 氦He:4 锂Li:7 铍Be:9 硼B:81 碳C:12 氮N:14 氧O:16 氟F:19 氖Ne:18 钠Na:23 镁Mg:231 铝Al:298 硅Si:209 磷P:30.97 硫S:306 氯Cl:345 氩Ar:396 钾K:310 钙Ca:40.08 以上是初中阶段常见的元素的相对原子质量。
5、银Ag(108)、钡Ba(137)、碘I(127)。相对原子质量的定义:由于原子的实际质量很小,如果人们用它们的实际质量来计算的话那就非常的麻烦,例如一个氢原子的实际质量为674×10千克,一个氧原子的质量为657×10千克。一个碳-12原子的质量为993×10千克。
6、元素周期表中最下面的数字为相对原子质量。相对原子质量是相对数值,比较的基准在历史上几经变更。1803年,道尔顿以氢的原子量1作为基准,发表了第一张原子量表。1826年,贝采利乌斯建议以氧的原子量的1/100为基准。后来,以氧的相对原子质量的1/16为基准,这在化学史上沿用了较长时间。