离子半径根简单离子半径是同一概念吗?
1、从高中化学角度讲简单离子半径,实际就是单个原子得失电子形成稳定结构的离子的半径,金属原子形成阳离子,非金属原子形成阴离子。在高中,离子半径的说法基本就是简单离子半径。
2、所以,考题里出现离子半径的考察题时,一般都是默认为“简单离子”的。
3、顾名思义,简单离子半径就是简单离子的半径,而离子半径,就是指所有离子的半径。就简单离子而言,什么是简单离子呢,应所中学常见的主族元素的常见化合价的离子都是简单离子,像钠离子、氯离子等。
4、不唯一。如Fe2+的离子半径就比Fe3+的大;H+就比H-的小。有的原子不能形成简单离子,如C等元素不会生成C4+或者C4-,只能以CO32-等离子形式存在。
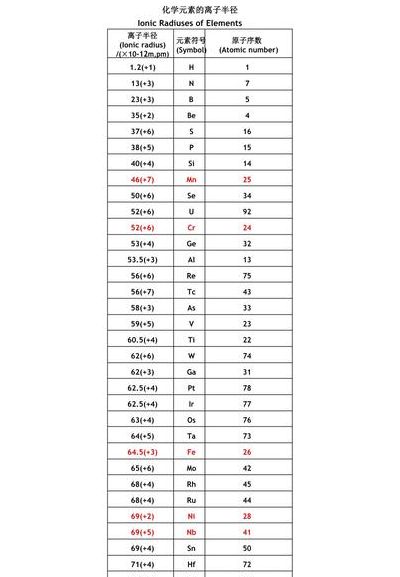
5、离子半径是说明离子大小的数值,它对离子在晶体结构中的作用有很大影响(各元素的离子半径列于表6-1)。各种离子半径的大小有如下规律:(1)阴离子一般较大,其数值在20~32之间;阳离子一般较小,其数值在67~0.13之间。其原因是原子得电子后半径加大,而失电子后半径缩小。
6、如果电子层数相同,也可以比较电子数,电子数越多,半径越大。因为电子和电子之间存在一个排斥作用力,电子数越多,相互之间的排斥越强烈,自然要占据更大的空间。简单离子简介:由单一元素组成的离子称为简单离子,即单核离子(只有一个核的离子),由单一元素组成的离子大多是简单离子。
简单离子半径比较,同层同核比电子
简单离子半径比较,同层同核比电子。电子数少的,离子半径要小。电子数多的,离子半径大。例如,钛离子,正二价钛离子半径为0.086,正三价钛离子少一个电子,离子半径为0.067,四价钛离子,要比二价钛离子少两个电子,离子半径为0.605。因此,对于同核原子,外层电子越少,离子半径越小。
在比较离子半径时,以下方法简单有效: 观察同一元素的不同形态:阳离子的半径通常小于其原子的半径,而阴离子的半径则大于其原子的半径。例如,钠离子(Na+)的半径小于钠原子(Na),而氯离子(Cl-)的半径大于氯原子(Cl)。
简单离子半径比较方法如下:同一元素的微粒,电子数越多,半径越大。如钠原子钠离子,氯原子氯离子,亚铁离子铁离子;同一周期内元素的微粒,阴离子半径大于阳离子半径。如氧离子锂离子。同类离子与原子半径比较相同。如钠离子镁离子铝离子,氟离子氯离子溴离子。
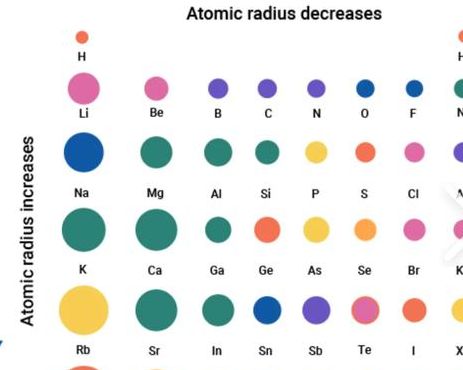
电子层数越多,半径越大。电子在原子核外按层排布,类似于洋葱,皮的层数越多,洋葱的半径自然就越大;如果电子层数相同,则比较核电荷数,核电荷数越多,半径越小。
简单离子半径是什么意思
从高中化学角度讲简单离子半径,实际就是单个原子得失电子形成稳定结构的离子的半径,金属原子形成阳离子,非金属原子形成阴离子。在高中,离子半径的说法基本就是简单离子半径。
简单离子半径指的是从原子核到最外层电离的平均距离。不唯一。如Fe2+的离子半径就比Fe3+的大;H+就比H-的小。有的原子不能形成简单离子,如C等元素不会生成C4+或者C4-,只能以CO32-等离子形式存在。
顾名思义,简单离子半径就是简单离子的半径,而离子半径,就是指所有离子的半径。就简单离子而言,什么是简单离子呢,应所中学常见的主族元素的常见化合价的离子都是简单离子,像钠离子、氯离子等。
如Cl最外层有7个电子,最容易得1个电子,变为Cl-离子,这就是简单离子(稳定结构的离子)。当然Cl可以失电子,变为化合态离子,如+++++7价,但这些都是不稳定结构的离子,当然,失电子越多,正价越高,离子半径就越小了。
离子半径是指离子中心离离子核心的距离。在元素周期表中,离子半径的比较可以通过以下几个规律进行: 原子半径和离子半径的趋势:原子半径从左上到右下逐渐减小。当一个原子失去或获得电子形成离子时,电子云的排列结构发生变化,导致离子半径发生变化。
简单离子半径大小怎么判断
简单离子半径大小判断如下:电子层数:首先需要看的就是电子层数,在离子半径大小的比较中,电子层数的多少代表着半径的大小,电子层数越多半径就越大,电子层数月少半径就越小。
当两个离子具有相同的电子数目,即等电子时,质子数越多,离子半径越小。这是因为在增加质子数的同时,原子核对电子的吸引力增强,导致电子云收缩,使得离子半径减小。
简单离子半径的比较方法多种多样。首先,对于等电子的离子,我们可以通过比较它们的质子数来判断半径的大小,质子数越大,离子的半径越小,比如Na+、Mg2+、Al3+,由于质子数越大,原子核对电子的吸引力也随之增强,从而导致半径减小。
离子半径的判断方法主要包括以下几个方面: 同一元素中,电子数越多的微粒,其半径通常越大。比如,钠原子比钠离子大,氯离子比氯原子小,亚铁离子则大于铁离子。 在同一周期中,阴离子的半径通常大于阳离子。例如,氧离子的半径大于锂离子。 类似的离子,其半径会随着核电荷数的增加而减小。
简单离子半径比较方法包括以下几个方面: 对于同一元素的微粒,电子数越多,半径越大。例如,钠原子的半径小于钠离子的半径,氯原子的半径大于氯离子的半径,亚铁离子的半径大于铁离子的半径。 在同一周期内,阴离子的半径大于阳离子的半径。例如,氧离子的半径大于锂离子的半径。
电子层数越多,半径越大。电子在原子核外按层排布,类似于洋葱,皮的层数越多,洋葱的半径自然就越大。如果电子层数相同,则比较核电荷数,核电荷数越多,半径越小。因为电子层数相同时,核电荷数越多,原子核对核外电子的吸引力越大,原子核自然将电子的距离拉的更近。
简单离子半径比较方法
在比较离子半径时,以下方法简单有效: 观察同一元素的不同形态:阳离子的半径通常小于其原子的半径,而阴离子的半径则大于其原子的半径。例如,钠离子(Na+)的半径小于钠原子(Na),而氯离子(Cl-)的半径大于氯原子(Cl)。
简单离子半径比较方法包括以下几个方面: 对于同一元素的微粒,电子数越多,半径越大。例如,钠原子的半径小于钠离子的半径,氯原子的半径大于氯离子的半径,亚铁离子的半径大于铁离子的半径。 在同一周期内,阴离子的半径大于阳离子的半径。例如,氧离子的半径大于锂离子的半径。
简单离子半径比较如下:同一元素的微粒,电子数越多,半径越大。如钠原子-钠离子,氯原子同一周期内元素的微粒,阴离子半径大于阳离子半径。如氧离子-锂离子。离子半径怎么比较。同类离子与原子半径比较相同。
比较方法如下:电子层数:电子层数越多,离子半径越大。电子在原子核外按层排布,类似于洋葱,皮的层数越多,洋葱的半径自然就越大。核电荷数:电子层数相同,比较核电荷数,核电荷数越多,离子半径越小。
如果电子层数相同,也可以比较电子数,电子数越多,半径越大。因为电子和电子之间存在一个排斥作用力,电子数越多,相互之间的排斥越强烈,自然要占据更大的空间。简单离子简介:由单一元素组成的离子称为简单离子,即单核离子(只有一个核的离子),由单一元素组成的离子大多是简单离子。
量动半导体PVD与CVD热处理工艺解决方案
蒸发镀膜是PVD技术中最早使用的一种方法,通过加热使镀膜材料蒸发,并在基材表面凝结成膜。常见的蒸发方法包括热蒸发和电子束蒸发。溅射镀膜 溅射镀膜通过离子轰击将材料从靶材表面溅射出来并沉积到基材表面。这种方法包括直流溅射和射频溅射。
PVD PVD是一种表面处理技术,通过物理方式在材料表面沉积薄膜。这种方法主要利用气体或蒸汽在固体表面上的凝聚特性,形成具有特定性能的薄膜。PVD技术广泛应用于制造工业,特别是在半导体、光学、电子和机械制造业中。
PVD技术在真空条件下利用物理方法将材料沉积在物件表面。PVD技术主要分为真空溅射镀膜、真空蒸发镀膜和真空离子镀膜。这三种方法可以满足不同基材的镀膜需求。
首先,PVD(物理蒸发镀膜)通常用于制备硬质薄膜,而CVD(化学气相沉积)则更常用于制备半导体材料。PVD工艺通常用于制备如金属、氧化物等硬质薄膜,其优点在于薄膜质量高、均匀性好,但缺点在于工艺温度较高,且薄膜种类相对较少。