铁和少量稀硝酸反应方程式
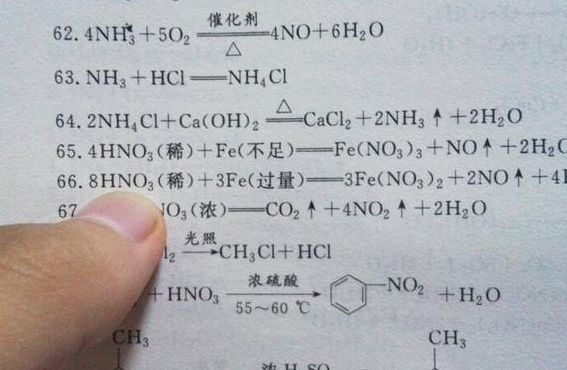
Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O。硝酸过量:Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O。铁过量:3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O。
少量铁与稀硝酸反应的化学方程式为:Fe+4HNO3=Fe(NO3)3+NO(气体)+2H2O。比例小于等于1:4,此时稀硝酸足量,铁单质全都被氧化成三价铁。过量铁与稀硝酸反应的化学方程式为:3Fe+8HNO3=3Fe(NO3)2+2NO(气体)+4H2O,当比例大于等于3:8,此时铁过量,生成物全部都是亚铁。
Fe少量:Fe+6HNO3(浓)=Fe(NO3)3+3NO2+3H2O (此反应要加热)HNO3浓度下降:Fe+4HNO3=Fe(NO3)3+NO+2H2O Fe过量:Fe+2Fe(NO3)3=3Fe(NO3)2 及得加上加热符号,三角形。
铁与稀硝酸反应方程式
当稀硝酸不足时,铁和稀硝酸反应的化学方程式为:3Fe + 8HNO3 = 3Fe(NO3)2 + 2NO↑ + 4H2O。 当稀硝酸足量时,反应方程式为:Fe + 4HNO3 = Fe(NO3)3 + NO↑ + 2H2O。
在化学反应中,铁与足量的稀硝酸反应可以产生铁离子、一氧化氮气体和水。反应方程式如下:Fe + 4HNO3(稀) = Fe(NO3)3 + NO↑ + 2H2O 稀硝酸作为氧化剂,能够将铁氧化为三价铁离子。在这个反应中,铁从零价被氧化到+3价,而硝酸根离子则被还原为一氧化氮气体。
当稀硝酸不足时,铁和稀硝酸反应的化学方程式为:3Fe+8HNO3=3Fe(NO3)2+2 NO↑+4H2O,当稀硝酸足量时,反应方程式为:Fe+4HNO3=Fe(NO3)3 + NO↑+2H2O。记生成物,还原产物都是NO,而铁足量则生成+2价铁,硝酸足量就是+3价铁。
铁和浓稀硝酸反应方程式
1、关于铁和浓稀硝酸反应方程式分享如下:少量铁:Fe+6HNO3(浓)=Fe(NO3)3+3NO2↑+3H2O(条件:加热)。过量铁:Fe+4HNO3(浓)=Fe(NO3)2+2NO2↑+2H2O(条件:加热)。
2、铁与过量稀硝酸反应的化学方程式可以表示为:3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2O。在这个反应中,铁与过量的稀硝酸反应生成硝酸亚铁和一氧化氮气体。硝酸的强氧化性使得铁被氧化为亚铁离子,而硝酸自身被还原为一氧化氮。
3、②硝酸过量时: Fe+4HNO(稀)=Fe(NO)+NO↑+2HO 浓硝酸不稳定,遇光或热会分解而放出二氧化氮,分解产生的二氧化氮溶于硝酸,从而使外观带有浅黄色。但稀硝酸相对稳定。
4、铁和稀硝酸之间的反应会产生氧化反应,生成氮氧化物和水。反应方程式如下:Fe(s) + 6HNO3(aq) → 3NO2(g) + 2H2O(l) + Fe(NO3)3(aq)在这个反应中,铁(Fe)固体与稀硝酸(HNO3)溶液反应,生成氮氧化物(NO2)气体、水(H2O)液体和硝酸铁(Fe(NO3)3)溶液。
5、Fe+4HNO3=Fe(NO3)3+NO(上箭头)+2H2O,由于酸过量,所以铁都被氧化成三价,稀硝酸,所以产物一氧化氮。