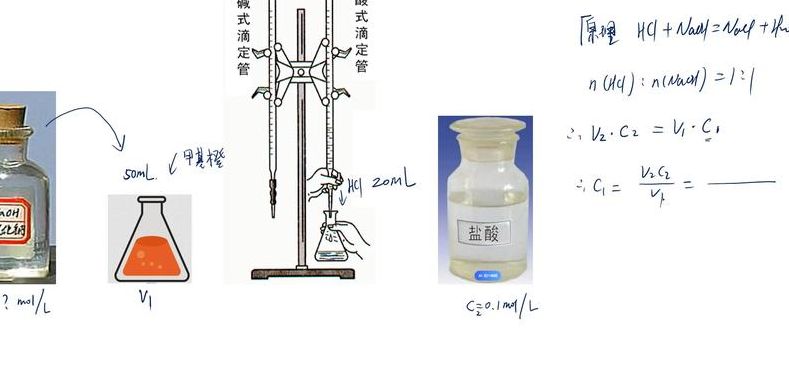
为什么“酸滴定碱一般用甲基橙,碱滴定酸一般用酚酞”
酸滴定碱一般用甲基橙,碱滴定酸一般用酚酞 首先,指示剂选择甲基橙或者酚酞,而不选择紫色石蕊,因为紫色石蕊的变色范围太宽,且颜色不容易辨别。在酸碱中和滴定的过程中有一个滴定终点和反应终点。滴定终点是指指示剂变色的终点,反应终点指的是酸碱恰好完全反应时的终点。
因为强碱弱酸反应生成的产物为强碱弱酸盐,滴定终点时溶液显碱性,酚酞在这种条件下会保持红色,无法有效指示滴定终点。因此,当进行强酸与弱碱的滴定时,选用甲基橙作为指示剂是更为合理的选择。甲基橙的变色范围与滴定终点的pH值相匹配,能够准确地指示滴定过程的终点,而酚酞则更适合用于强碱与弱酸的滴定。
理由:当碱滴酸的时候,甲基橙指示剂颜色由红变黄,终点颜色判定非常不明显,不容易控制。而酚酞是无色变红色,颜色非常好判定。扩展内容:甲基橙 甲基橙在分析化学中是一种常用的酸碱滴定指示剂,不适用于作有机酸类化合物滴定的指示剂。
选择甲基橙作为强酸滴定碱液的指示剂,主要是因为滴定终点时溶液颜色由黄色变为橙色,这种颜色变化更易被观察到,减少了滴定过量的误差。
强酸滴定强碱可以用酚酞、甲基橙作为指示剂。当溶液颜色由浅变深时易被观察到,反之则不易察觉,从而造成滴过量,产生误差。因此对于指示剂的选择有下列情况:强酸滴定强碱时,应选甲基橙(或甲基红),因为滴定终点时溶液颜色由黄色变为橙色。
强酸滴定强碱用什么指示剂
(1) 强酸滴定强碱: 如NaOH滴定HCl 一般浓度以0.1000mol /l ,突跃范围3-7,指示剂 :酚酞、甲基红、甲基橙 (二)强碱滴定弱酸: 如NaOH滴定HAc 突跃范围PH 74-7 ,计量点PH72 。选碱性范围指示剂酚酞、百里酚酞。不能用酸性指示剂甲基红,甲基橙。
强酸滴定强碱可以用甲基红指示剂,强碱滴定强酸可以用酚酞指示剂。强酸滴弱碱用甲基橙(黄变橙)或酚酞(红变无色)。强碱滴弱酸用酚酞无色变粉红,注意变色范围是2(粉红)~10(红)。用酸作滴定剂可以测定碱,用碱作滴定剂可以测定酸,这是一种用途极为广泛的分析方法。
然而,在强酸与弱碱滴定的情况下,滴定终点生成的盐显示出酸性,此时使用甲基橙作为指示剂可以减小误差。相反,在强碱与弱酸滴定的过程中,滴定终点生成的盐显示出碱性,此时使用酚酞作为指示剂更为合适。值得注意的是,强酸与强碱滴定时,不能随意互换指示剂,否则可能会超出误差允许的范围。
酸碱滴定过程中指示剂的选择原则是:强酸弱碱:甲基橙;强碱弱酸:酚酞;强酸强碱:酚酞或甲基橙。指示剂变色要明显。滴定终点时与指示剂变色范围相一致。
强酸滴定强碱时,终点pH= 终点pH突跃范围一般在 5 到 8 个pH单位。所以任何酸碱指示剂其变色范围在pH= 4到10 都可以用。使用酚酞和甲基橙只是为了方便。主要是这两种指示剂制备方便,又很稳定。属于一般实验室里的常备指示剂。
强酸滴定强碱可以用酚酞、甲基橙作为指示剂。当溶液颜色由浅变深时易被观察到,反之则不易察觉,从而造成滴过量,产生误差。因此对于指示剂的选择有下列情况:强酸滴定强碱时,应选甲基橙(或甲基红),因为滴定终点时溶液颜色由黄色变为橙色。
酸碱滴定中如何指示剂选择?
1、在酸碱滴定中,指示剂的选择是基于以下原则: 对于强酸与弱碱的反应,通常选择甲基橙作为指示剂;对于强碱与弱酸的反应,则选择酚酞;而对于强酸与强碱的反应,酚酞或甲基橙均可使用。 指示剂的颜色变化应当明显,以便于观察。 理想的情况是,指示剂的颜色变化范围与滴定终点pH值的变动范围相吻合。
2、酸碱中和滴定指示剂的选择如下:强酸弱碱:甲基橙;强碱弱酸:酚酞;强酸强碱:酚酞或甲基橙。指示剂变色要明显。滴定终点时与指示剂变色范围相一致。
3、在酸碱滴定中,指示剂的选择原则:指示剂的变色范围应该全部或部分落入滴定的pH值突跃范围内。指示剂的变色点应接近或等于化学计量点的pH值。根据酸碱滴定中指示剂的选择原则,我们可以更好地判断滴定过程中pH值的变化,从而更准确地进行滴定操作。
4、百里酚蓝:红——黄;甲基黄:红——黄;甲基橙:红——黄;溴酚蓝:黄——紫;溴甲酚绿:黄——蓝;甲基红:红——黄;溴百里酚兰:黄——蓝;中性红:红——黄橙;苯酚红:黄——红;酚酞:无——红;百里酚酞:无——蓝。指示剂用量过多,还会影响变色的敏锐性。
5、酸碱滴定过程中指示剂的选择原则主要包括几个方面。首先,对于不同类型的酸碱,应选择适合的指示剂,如强酸弱碱时选用甲基橙,强碱弱酸时选用酚酞,而强酸强碱时则可选用酚酞或甲基橙。此外,指示剂的颜色变化需明显,以便于观察滴定过程中的颜色变化,从而确定滴定终点。
6、(三)强酸滴定弱碱:HCl 滴定NH .H O ,PH24-3 ,计量点PH28 ,选甲基红、溴甲酚绿 。(四)强碱滴定多元酸:两个计量点,用甲基橙和酚酞的混合指示剂。注意事项 摇瓶时,应微动腕关节,使溶液像一个方向做圆周运动,但是勿使瓶口接触滴定管,溶液也不得溅出。
如何用酸碱指示剂滴定碱
1、测定水中的碱度,基础方法是通过标准酸进行滴定。常用的两种方法是酸碱指示剂滴定法和电位滴定法。
2、准备待测溶液:将待测的酸或碱溶液准确量取到容量瓶中,并加入适量的稀释剂,以达到合适的滴定范围。滴定过程:使用滴定管将标定好的滴定液滴入待测溶液中,同时加入酸碱指示剂。每滴加一滴滴定液,轻轻摇晃容器使之充分混合。当指示剂的颜色发生明显变化,表示酸碱反应接近终点。
3、准备实验室所需的设备和试剂。包括:酸碱溶液、滴定瓶、滴管、酸碱指示剂、等容移液管、烧杯、蒸馏水等。用等容移液管将待测溶液转移到滴定瓶中。注意,需要控制好溶液的体积。添加几滴指示剂到滴定瓶中。选择合适的指示剂,例如酚酞,它是一种变色指示剂,由无色到红色。
4、强酸滴定强碱可以用甲基红指示剂,强碱滴定强酸可以用酚酞指示剂。强酸滴弱碱用甲基橙(黄变橙)或酚酞(红变无色)。强碱滴弱酸用酚酞无色变粉红,注意变色范围是2(粉红)~10(红)。用酸作滴定剂可以测定碱,用碱作滴定剂可以测定酸,这是一种用途极为广泛的分析方法。
酸滴定碱用什么指示剂
强酸滴定强碱可以用甲基红指示剂,强碱滴定强酸可以用酚酞指示剂。强酸滴弱碱用甲基橙(黄变橙)或酚酞(红变无色)。用酸作滴定剂可以测定碱,用碱作滴定剂可以测定酸,这是一种用途极为广泛的分析方法。最常用的酸标准溶液是盐酸,有时也用硝酸和硫酸。
(1) 强酸滴定强碱: 如NaOH滴定HCl 一般浓度以0.1000mol /l ,突跃范围3-7,指示剂 :酚酞、甲基红、甲基橙 (二)强碱滴定弱酸: 如NaOH滴定HAc 突跃范围PH 74-7 ,计量点PH72 。选碱性范围指示剂酚酞、百里酚酞。不能用酸性指示剂甲基红,甲基橙。
在酸碱滴定中,指示剂的选择是基于以下原则: 对于强酸与弱碱的反应,通常选择甲基橙作为指示剂;对于强碱与弱酸的反应,则选择酚酞;而对于强酸与强碱的反应,酚酞或甲基橙均可使用。 指示剂的颜色变化应当明显,以便于观察。 理想的情况是,指示剂的颜色变化范围与滴定终点pH值的变动范围相吻合。
强酸滴定强碱可以用酚酞、甲基橙作为指示剂。当溶液颜色由浅变深时易被观察到,反之则不易察觉,从而造成滴过量,产生误差。因此对于指示剂的选择有下列情况:强酸滴定强碱时,应选甲基橙(或甲基红),因为滴定终点时溶液颜色由黄色变为橙色。
(1) 在强酸滴定强碱的情况下,例如NaOH滴定HCl,通常使用的浓度为0.1000mol/L。滴定的突跃范围在3至7之间。适用的指示剂包括酚酞、甲基红和甲基橙。(2) 当进行强碱滴定弱酸,比如NaOH滴定HAc,突跃范围为pH 74至7,计量点的pH为72。此时应选择碱性范围的指示剂,如酚酞和百里酚酞。
酸滴碱用什么指示剂?
强酸滴定强碱可以用甲基红指示剂,强碱滴定强酸可以用酚酞指示剂。强酸滴弱碱用甲基橙(黄变橙)或酚酞(红变无色)。用酸作滴定剂可以测定碱,用碱作滴定剂可以测定酸,这是一种用途极为广泛的分析方法。最常用的酸标准溶液是盐酸,有时也用硝酸和硫酸。
(1) 强酸滴定强碱: 如NaOH滴定HCl 一般浓度以0.1000mol /l ,突跃范围3-7,指示剂 :酚酞、甲基红、甲基橙 (二)强碱滴定弱酸: 如NaOH滴定HAc 突跃范围PH 74-7 ,计量点PH72 。选碱性范围指示剂酚酞、百里酚酞。不能用酸性指示剂甲基红,甲基橙。
(1) 在强酸滴定强碱的情况下,例如NaOH滴定HCl,通常使用的浓度为0.1000mol/L。滴定的突跃范围在3至7之间。适用的指示剂包括酚酞、甲基红和甲基橙。(2) 当进行强碱滴定弱酸,比如NaOH滴定HAc,突跃范围为pH 74至7,计量点的pH为72。此时应选择碱性范围的指示剂,如酚酞和百里酚酞。
强碱滴定强酸可以用酚酞指示剂。强酸滴弱碱用甲基橙(黄变橙)或酚酞(红变无色)。强碱滴弱酸用酚酞无色变粉红,注意变色范围是2(粉红)~10(红)。用酸作滴定剂可以测定碱,用碱作滴定剂可以测定酸,这是一种用途极为广泛的分析方法。最常用的酸标准溶液是盐酸,有时也用硝酸和硫酸。