氨水在水溶液中的电离方程式
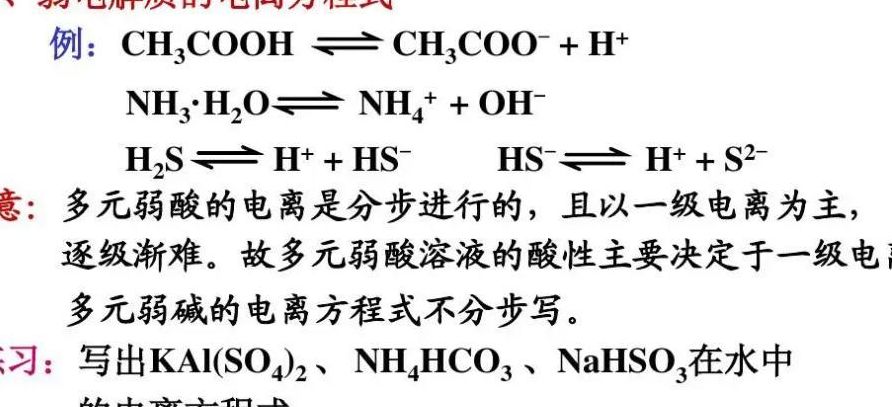
1、主要成分是氨气和水化合的NHH2O叫一水和氨他的电离是主要的。
2、NHH2O62NH4+ + OH- 在水中或熔融状态下能完全电离的化合物是强电解质 在弱酸,弱碱,非金属氧化物都是弱电解质 如弱酸:H2S,HF,C6H5OH,H2CO3,H2SO3,CH3COOH等;弱碱:NHH2O,Fe(OH)3等;非金属氧化物:SiO2,As2O3,H2O等。
3、氨水(NH3·H2O)是弱电解质,只有部分电离,电离方程式中的等式是可逆的.NH3+H2O===NH3·H2O===(NH4+)+(OH-)NH3+H2O===(NH4+)+(OH-)以上两种都是可以的。氨水又称阿摩尼亚水,主要成分为NH3·H2O,是氨的水溶液,无色透明且具有刺激性气味。
nh3h2o的电离方程式是什么?
主要成分是氨气和水化合的NHH2O叫一水和氨他的电离是主要的。
NHH2O == NH4+ + OH-(注:等号应写为可逆符号,因为是弱电解质,部分电离)。①加水稀释会使氨水浓度减小,促进NH3H20电离,电离平衡正向移动。故答案为:正。②加入少量氯化铵固体,增大了铵根离子浓度,电离平衡逆向移动。故答案为:逆。
nh3·h20的电离方程式可以表示为:NH3·H2O= NH4++OH-。nh3·h20的电离这个方程式表明,NH3·H2O在水中解离成NH4+和OH-离子。其中,NH3·H2O是弱碱,其电离过程是可逆的,即存在电离平衡。在电离平衡状态下,NH3·H2O和NH4+、OH-的浓度是相对稳定的。
氨水电离方程式是什么
NHH2O == NH4+ + OH-(注:等号应写为可逆符号,因为是弱电解质,部分电离)。①加水稀释会使氨水浓度减小,促进NH3H20电离,电离平衡正向移动。故答案为:正。②加入少量氯化铵固体,增大了铵根离子浓度,电离平衡逆向移动。故答案为:逆。
NHH2O62NH4+ + OH- 在水中或熔融状态下能完全电离的化合物是强电解质 在弱酸,弱碱,非金属氧化物都是弱电解质 如弱酸:H2S,HF,C6H5OH,H2CO3,H2SO3,CH3COOH等;弱碱:NHH2O,Fe(OH)3等;非金属氧化物:SiO2,As2O3,H2O等。
氨水(NH3·H2O)是弱电解质,只有部分电离,电离方程式中的等式是可逆的.NH3+H2O===NH3·H2O===(NH4+)+(OH-)NH3+H2O===(NH4+)+(OH-)以上两种都是可以的。氨水又称阿摩尼亚水,主要成分为NH3·H2O,是氨的水溶液,无色透明且具有刺激性气味。
主要成分是氨气和水化合的NHH2O叫一水和氨他的电离是主要的。
NH3·H2O是弱电解质,只有部分电离,电离方程式中的等式应改为可逆符号。NH3·H2O NH4+ + OH- (“~”表示可逆)。NH4Cl是盐,是强电解质,认为是完全电离。NH4Cl=NH4+ + Cl-。
氨水电离方程式为:NH 3 ·H 2 ONH 4 + +OHˉ(可逆反应),电离常数:K=8×10-5(25℃)。氨水又称阿摩尼亚水,主要成分为NH 3 ·H 2 0,是氨的水溶液,无色透明且具有刺激性气味。氨的熔点-77℃,沸点-35℃,密度0.91g/cm。氨气易溶于水、乙醇。
nh3·h2o的电离方程式是什么?
1、NHH2O == NH4+ + OH-(注:等号应写为可逆符号,因为是弱电解质,部分电离)。①加水稀释会使氨水浓度减小,促进NH3H20电离,电离平衡正向移动。故答案为:正。②加入少量氯化铵固体,增大了铵根离子浓度,电离平衡逆向移动。故答案为:逆。
2、电离方程式:NHH2O=NH4++OH-。一水合氨是一种无机化合物,化学式NH3·H2O。易挥发逸出氨。有强烈的刺激性气味,易与水混溶。显弱碱性。但实验已经证明一水合氨晶体将在高压下转化为氢氧化铵晶体。一水合氨化学性质 一水合氨有一定的腐蚀作用。对铜的腐蚀比较强,对钢铁比较差,对水泥腐蚀不大。
3、nh3·h20的电离方程式可以表示为:NH3·H2O= NH4++OH-。nh3·h20的电离这个方程式表明,NH3·H2O在水中解离成NH4+和OH-离子。其中,NH3·H2O是弱碱,其电离过程是可逆的,即存在电离平衡。在电离平衡状态下,NH3·H2O和NH4+、OH-的浓度是相对稳定的。
氨水电离方程式
1、NHH2O == NH4+ + OH-(注:等号应写为可逆符号,因为是弱电解质,部分电离)。①加水稀释会使氨水浓度减小,促进NH3H20电离,电离平衡正向移动。故答案为:正。②加入少量氯化铵固体,增大了铵根离子浓度,电离平衡逆向移动。故答案为:逆。
2、氨水(NH3·H2O)是弱电解质,只有部分电离,电离方程式中的等式是可逆的.NH3+H2O===NH3·H2O===(NH4+)+(OH-)NH3+H2O===(NH4+)+(OH-)以上两种都是可以的。氨水又称阿摩尼亚水,主要成分为NH3·H2O,是氨的水溶液,无色透明且具有刺激性气味。
3、氨水电离方程式为:NH 3 ·H 2 ONH 4 + +OHˉ(可逆反应),电离常数:K=8×10-5(25℃)。氨水又称阿摩尼亚水,主要成分为NH 3 ·H 2 0,是氨的水溶液,无色透明且具有刺激性气味。氨的熔点-77℃,沸点-35℃,密度0.91g/cm。氨气易溶于水、乙醇。
4、主要成分是氨气和水化合的NHH2O叫一水和氨他的电离是主要的。
氨水的电离化学方程式
1、氨水的电离方程式是NH·HO NH + OH氨水的电离过程 氨水在水中部分电离为铵根离子(NH4+)和氢氧根离子(OH-),这是一个可逆的过程。这意味着在电离的同时,氨水也会结合成氨分子(NH3·H2O)。
2、你那个方程式本身就是错的。这是有关氨水的一些反应化方程式。
3、先计算[H+],一元弱酸[H+]计算有以下两个公式,(1) [H+]= [-ka+根号(ka+4c*ka)]/2 (2) [H+] = 根号(c*ka)其中c是分析浓度,ka是电离常数。一般认为当c*ka 10*kw 且 c/ka 100的时候,可以使用(2)式,否则应该使用更复杂但也更精确的(1)。